|
Натрия гидрокарбонат (пищевая сода)
| |
| Юрий | Дата: Суббота, 03.05.2014, 20:37 | Сообщение # 1 |
|
Земля
Группа: admin
Сообщений: 1694
Статус: Offline
| Натрия гидрокарбонат (англ. sodium bicarbonate; синонимы: двууглекислый натрий, бикарбонат натрия, питьевая сода, пищевая сода) — антацидное, нормализующее кислотно-щелочное равновесие вещество. Гидрокарбонат натрия — химическое вещество Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Химическая формула гидрокарбоната натрия: NaHCO 3.  Гидрокарбонат натрия — белый кристаллический порошок без запаха, солено-щелочного вкуса. Гидрокарбонат натрия устойчив в сухом воздухе, медленно разлагается во влажном. Легко растворим в воде с образованием щелочных растворов. Кислотность пятипроцентного раствора гидрокарбоната натрия = 8,1 pH. Гидрокарбонат натрия практически нерастворим в этаноле. Молекулярная масса 84,01. Гидрокарбонат натрия реагирует с кислотами с образованием соли и угольной кислоты, которая сразу же распадается на углекислый газ и воду. Натрия гидрокарбонат — лекарственное средство Натрия гидрокарбонат (такое его название принято в фармацевтике) — международное непатентованное наименование (МНН) лекарственного средства. По фармакологическому указателю натрия гидрокарбонат относится к группам «Регуляторы водно-электролитного баланса и КЩС» и «Антациды», по АТХ — к группе «B05 Плазмозамещающие и перфузионные растворы» и имеет коды B05CB04 и B05XA02. ®
|
| |
| |
| Юрий | Дата: Суббота, 03.05.2014, 20:41 | Сообщение # 2 |
|
Земля
Группа: admin
Сообщений: 1694
Статус: Offline
| Бикарбонаты, как естественное средство защиты органов ЖКТ от кислоты В желудке и двенадцатиперстной кишке ионы бикарбонатов HCO 3– секретируются клетками поверхностного эпителия. Бикарбонаты играют важнейшую роль в пищеварительном процессе, нейтрализуя соляную кислоту и защищая ткани органов пищеварения от её воздействия.  В кислой среде ионы бикарбоната необратимо реагируют с ионами водорода с образованием воды и углекислого газа: H + + HCO 3–= Н 2CO 3 = H 2O + CO 2 Бикарбонаты вместе со слизью составляют так называемый предэпителиальный уровень защиты слизистой оболочки желудка. Слизь не может защищать эпителий от ионов Н + без постоянно поступающих в нее бикарбонатов, также секретируемых поверхностным эпителием. С помощью бикарбонатов в слизи поддерживается градиент рН: на поверхности, обращенной в просвет желудка, среда кислая, а у эпителиоцитов — нейтральная или слабощелочная. Немедленного смешивания бикарбонатов с кислым секретом в просвете и нейтрализации не происходит: слой слизи образует барьер, благодаря которому и существует градиент рН. Бикарбонаты также секретируются протоковыми клетами поджелудочной железы и вместе с соком поджелудочной железы поступают в двенадцатиперстную кишку, где участвуют в нейтрализации соляной кислоты.
|
| |
| |
| Юрий | Дата: Суббота, 03.05.2014, 20:47 | Сообщение # 3 |
|
Земля
Группа: admin
Сообщений: 1694
Статус: Offline
| Концентрация бикарбонат-ионов
Концентрация бикарбонатов (ионов HCO3-) в плазме крови является третьим основным показателем кислотно-основного состояния.
На практике различают показатели актуальных (истинных) бикарбонатов и стандартных бикарбонатов.
Актуальные бикарбонаты (AB, АБ) – это концентрация ионов HCO3– в исследуемой крови при 38°С и реальных значениях pH и pCO2.
Стандартные бикарбонаты (SB, СБ) – это концентрация ионов HCO3– в
исследуемой крови при приведении ее в стандартные условия: полное
насыщение кислородом крови, уравновешивание при 38°С с газовой смесью, в
которой pCO2 равно 40 мм рт.ст.
У здоровых людей концентрация актуальных и стандартных бикарбонатов практически одинакова.
Диагностическое значение концентрации бикарбонатов в крови состоит,
прежде всего, в определении характера нарушений кислотно-основного
состояния (метаболического или респираторного).
Показатель в первую очередь изменяется при метаболических нарушениях:
• при метаболическом ацидозе показатель HCO3– снижается, т.к. расходуется на нейтрализацию кислых веществ (буферная система)
• при метаболическом алкалозе – повышается
Так как угольная кислота очень плохо диссоциирует и ее накопление в
крови практически не отражается на концентрации HCO3–, то при первичных
респираторных нарушениях изменение бикарбонатов невелико.
При компенсации метаболического алкалоза бикарбонаты накапливаются
вследствие урежения дыхания, при компенсации метаболического ацидоза – в
результате усиления их почечной реабсорбции.
|
| |
| |
| Юрий | Дата: Среда, 07.05.2014, 03:02 | Сообщение # 4 |
|
Земля
Группа: admin
Сообщений: 1694
Статус: Offline
| КИСЛОТНО-ЩЕЛОЧНОЕ РАВНОВЕСИЕ. Во-первых, здесь из разных источников собрана информация по кислотно-щелочному равновесию. С разных сторон, разным языком, под разными углами зрения, порой просто короткие факты. А во-вторых, разумеется, здесь же я собираю и всё, что касается нарушения этого равновесия - все факторы, которые его нарушают в ту или иную сторону. В основном это, конечно проблема закисления - ацидоза. Концентрация бикарбонат-ионов Концентрация бикарбонатов (ионов HCO3-) в плазме крови является третьим основным показателем кислотно-основного состояния. На практике различают показатели актуальных (истинных) бикарбонатов и стандартных бикарбонатов. Актуальные бикарбонаты (AB, АБ) – это концентрация ионов HCO3– в исследуемой крови при 38°С и реальных значениях pH и pCO2. Стандартные бикарбонаты (SB, СБ) – это концентрация ионов HCO3– в исследуемой крови при приведении ее в стандартные условия: полное насыщение кислородом крови, уравновешивание при 38°С с газовой смесью, в которой pCO2 равно 40 мм рт.ст. У здоровых людей концентрация актуальных и стандартных бикарбонатов практически одинакова. Диагностическое значение концентрации бикарбонатов в крови состоит, прежде всего, в определении характера нарушений кислотно-осн овного состояния (метаболического или респираторного). Показатель в первую очередь изменяется при метаболических нарушениях: • при метаболическом ацидозе показатель HCO3– снижается, т.к. расходуется на нейтрализацию кислых веществ (буферная система) • при метаболическом алкалозе – повышается Так как угольная кислота очень плохо диссоциирует и ее накопление в крови практически не отражается на концентрации HCO3–, то при первичных респираторных нарушении изменение бикарбонатов невелико. При компенсации метаболического алкалоза бикарбонаты накапливаются вследствие урежения дыхания, при компенсации метаболического ацидоза – в результате усиления их почечной реабсорбции.
|
| |
| |
| Юрий | Дата: Среда, 07.05.2014, 03:12 | Сообщение # 5 |
|
Земля
Группа: admin
Сообщений: 1694
Статус: Offline
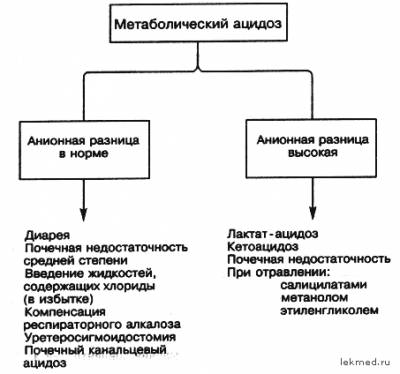
| Концентрация буферных оснований Еще одним показателем, характеризующим состояние кислотно-осн овного состояния, является концентрация буферных оснований (buffer bases, ВВ), отражающая сумму всех анионов цельной крови, в основном анионов бикарбоната и хлора, к другим анионам относятся ионы белков, сульфаты, фосфаты, лактат, кетоновые тела и т.п. Этот параметр почти не зависит от изменения парциального давления углекислого газа в крови, но отражает продукцию кислот тканями и частично функцию почек. По величине буферных оснований можно судить о сдвигах кислотно-осн овного состояния, связанных с увеличением или уменьшением содержания нелетучих кислот в крови (т.е. всех, кроме угольной кислоты). На практике используемым параметром концентрации буферных оснований является параметр "остаточные анионы" или "неопределяемые анионы" или "анионное несоответствие" или "анионная разница". В основе использования показателя анионной разницы лежит постулат об электронейтральности, т.е. количество отрицательных (анионов) и положительных (катионов) в плазме крови должно быть одинаковым. Если же экспериментально определить количество наиболее представленных в плазме крови ионов Na+, K+, Cl–, HCO3–, то разность между катионами и анионами составляет примерно 12 ммоль/л. 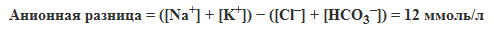 Увеличение величины анионной разницы сигнализирует о накоплении неизмеряемых анионов (лактат, кетоновые тела) или катионов, что уточняется по клинической картине или по анамнезу. Показатели общих буферных оснований и анионной разницы особенно информативны при метаболических сдвигах кислотно-осн овного состояния, тогда как при респираторных нарушениях его колебания незначительны. ******************************************************************************************************************************************** ** Разница анионная Разница анионная - разница между суммой измеренных катионов и анионов в плазме или сыворотке, вычисленная по формуле: (Na+ • К+) - (С1~ • НСO3) = 20 ммоль/л. Может быть увеличена при диабетическом ацидозе или молочнокислом ацидозе; не изменена или уменьшена при метаболическом ацидозе с потерей бикарбоната ®
******************************************************************************************************************************************** ***
®
|
| |
| |
| Юрий | Дата: Среда, 07.05.2014, 03:25 | Сообщение # 6 |
|
Земля
Группа: admin
Сообщений: 1694
Статус: Offline
| Избыток буферных оснований Избыток оснований (base excess, BE, ИО) – разница между фактической и должной величинами буферных оснований. По значению показатель может быть положительным (избыток оснований) или отрицательным (дефицит оснований, избыток кислот).
Показатель по диагностической ценности выше, чем показатели концентрации актуальных и стандартных бикарбонатов. Избыток оснований отражает сдвиги количества оснований буферных систем крови, а актуальные бикарбонаты – только концентрацию.
Наибольшие изменения показателя отмечаютcя при метаболических нарушениях: при ацидозе выявляется нехватка оснований крови (дефицит оснований, отрицательные значения), при алкалозе – избыток оснований (положительные значения). Предел дефицита, совместимый с жизнью, 30 ммоль/л.
При респираторных сдвигах показатель меняется незначительно.
Величина рН формирует активность клеток
Кислотно-основное равновесие – это состояние, которое обеспечивается физиологическими и физико-химическими процессами, составляющими функционально единую систему стабилизации концентрации ионов Н+. Нормальные величины концентрации ионов Н+ около 40 нмоль/л, что в 106 раз меньше, чем концентрация многих других веществ (глюкоза, липиды, минеральные вещества).
Совместимые с жизнью колебания концентрации ионов Н+ располагаются в пределах 16-160 нмоль/л.
Так как реакции обмена веществ часто связаны с окислением и восстановлением молекул, то в этих реакциях обязательно принимают участие соединения, выступающие в качестве акцептора или донора ионов водорода. Участие других соединений сводится к обеспечению неизменности концентрации ионов водорода в биологических жидкостях.
Стабильность внутриклеточной концентрации Н+ необходима для:
• оптимальной активности ферментов мембран, цитоплазмы и внутриклеточных органелл
• формирования электро-химического градиента мембраны митохондрий на должном уровне и достаточную наработку АТФ в клетке. Сдвиги концентрации ионов Н+ приводят к изменению активности внутриклеточных ферментов даже в пределах физиологических значений.
Например, ферменты глюконеогенеза в печени более активны при закислении цитоплазмы, что актуально при голодании или мышечной нагрузке, ферменты гликолиза – при обычных рН.
Стабильность внеклеточной концентрации ионов Н+ обеспечивает:
• оптимальную функциональную активность белков плазмы крови и межклеточного пространства (ферменты, транспортные белки),
• растворимость неорганических и органических молекул,
• неспецифическую защиту кожного эпителия,
• отрицательный заряд наружной поверхности мембраны эритроцитов.
|
| |
| |
| Юрий | Дата: Среда, 07.05.2014, 03:31 | Сообщение # 7 |
|
Земля
Группа: admin
Сообщений: 1694
Статус: Offline
| При изменении концентрации ионов Н+ в крови активируется компенсационная деятельность двух крупных систем организма: 1. Система химической компенсации • действие внеклеточных и внутриклеточных буферных систем, • интенсивность внутриклеточного образования ионов Н+ и НСО3–. 2. Система физиологической компенсации • легочная вентиляция и удаление СО2, • почечная экскреция ионов Н+ (ацидогенез, аммониегенез), реабсорбция и синтез НСО3–. 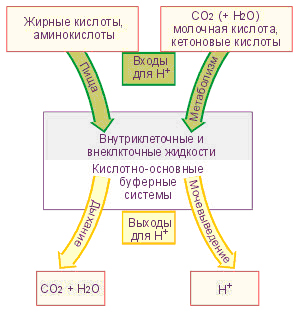 Кислород-связанные показатели Оксигемоглобин (HbО2) – отражает процентное отношение количества оксигемоглобина (HbО2) к сумме всех гемоглобиновых фракций (общему гемоглобину). В норме это должно быть 94-97% Насыщение (сатурация) гемоглобина кислородом (HbOSAT, SО2), представляет собой отношение фракции оксигенированного гемоглобина к тому количеству гемоглобина в крови, который способен транспортировать О2.
Например, насыщение гемоглобина кислородом составляет 95%, величина оксигемоглобина составляет 53%. Это означает, что несмотря на нормальное поступление кислорода, существует некоторая часть гемоглобина, не способная к его связыванию.
Показатель используется при цианозе и эритроцитозе, он помогает различить пониженную оксигенацию крови (например, при заболеваниях легких) и смешивание крови с венозной кровью при артерио-венозном шунте. Хотя растворенный кислород составляет менее 10% общего кислорода в крови, он находится в динамическом равновесии между кислородом эритроцитов и тканей. Данный показатель является основным при характеристике гипоксии. |
| |
| |
| Юрий | Дата: Среда, 07.05.2014, 03:40 | Сообщение # 8 |
|
Земля
Группа: admin
Сообщений: 1694
Статус: Offline
| Быстрая компенсация сдвигов рН Быстрая, т.е. повседневная компенсация сдвигов рН осуществляется за счет т.наз. буферных систем крови. Буферные системы – это соединения, противодействующие резким изменениям концентрации ионов Н+. Буферные системы вступают в действие практически моментально, и через несколько минут их эффект достигает максимума возможного. Существует несколько буферных систем организма – бикарбонатная, фосфатная, белковая, гемоглобиновая. 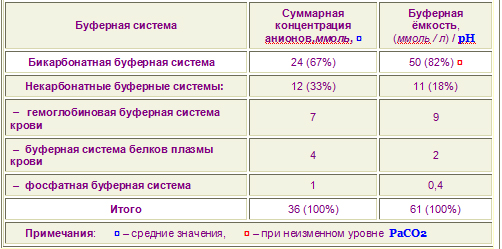 Бикарбонатная буферная система Эта система состоит из бикарбонат-иона (НСО3–) и угольной кислоты (Н2СО3), буферная мощность составляет 65% от общей буферной емкости крови. В норме отношение HCO3– к H2CO3 равно 20 : 1. Работа этой системы неразрывно и тесно связана с легкими. При поступлении в кровь более сильной кислоты, чем угольная, ионы бикарбоната натрия взаимодействуют с ней, происходит реакция обмена и образуется соответствующая соль и угольная кислота. В результате, благодаря связыванию введенной в систему кислоты, концентрация ионов водорода значительно понижается. NaНСО3 + Н-Анион > H2CO3 + Na+ + Анион– При поступлении оснований они реагируют с угольной кислотой и образуют соли бикарбонатов: H2CO3 + Катион-ОН > Катион+ + HCO3– + Н2О Возникающий при этом дефицит угольной кислоты компенсируется уменьшением выделения CO2 легкими ( и в этот момент мы сами не замечаем как задерживаем дыхание на какое-то время. А еще лучше в этом плане работает регулярная практика задержки дыхания в пранаяме - кумбхака. ALG) При накоплении угольной кислоты в крови не происходит параллельного значимого увеличения концентрации H2CO3-, т.к. угольная кислота очень плохо диссоциирует ( к вопросу о безопасности практики кумбхаки в параняме. Как только дыхание
восстанавливается, излишек угольной кислоты тут же удаляется. ALG) Благодаря работе бикарбонатного буфера концентрация водородных ионов понижается по двум причинам: • угольная кислота является очень слабой кислотой и плохо диссоциирует • в крови легких благодаря присутствию в эритроцитах фермента карбоангидразы, угольная кислота быстро расщепляется с образованием CO2, удаляемого с выдыхаемым воздухом: H2CO3> Н2О + СО2^ ( и тоже, получается, сто очков в плюс к дыхательной практике, ведь если легкие работают не на полный объем - как это у нас
столь распространено - СО2 выделяется не в полном объеме, и эффективность работы этого важнейшего буфера существенно снижается. ALG) Кроме эритроцитов, значительная активность карбоангидразы отмечена в эпителии почечных канальцев, клетках слизистой оболочки желудка, коре надпочечников и клетках печени, в незначительных количествах – в центральной нервной системе, поджелудочной железе и других органах. ® |
| |
| |
| Юрий | Дата: Среда, 07.05.2014, 03:44 | Сообщение # 9 |
|
Земля
Группа: admin
Сообщений: 1694
Статус: Offline
| В легких после удаления СО2 (угольной кислоты) происходит защелачивание крови.
Основа рака - кислая среда.
|
| |
| |
| Юрий | Дата: Среда, 20.08.2014, 10:13 | Сообщение # 10 |
|
Земля
Группа: admin
Сообщений: 1694
Статус: Offline
| Справочник химика 21
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
|
| |
| |
|